

张昊文副教授、石小林博士与实验团队合影
文章链接:https://www.pnas.org/doi/10.1073/pnas.2208506119
转载请注明出处。
激光制造网 来源:中物院十所2022-10-29
我要评论(0 )
![]()
![]()
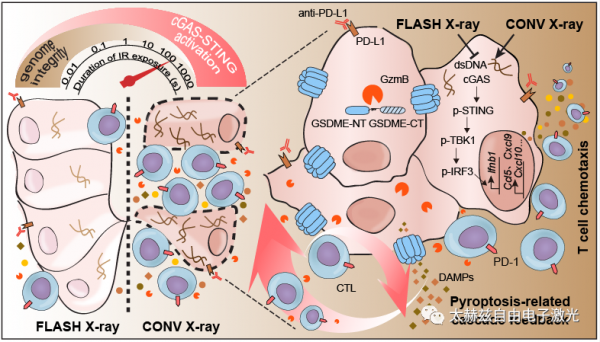
近年来,肿瘤放疗联合免疫治疗在临床取得了巨大成功,对于已经发生寡转移(转移灶小于等于3个)的晚期恶性肿瘤,基于抗PD-1/PD-L1抗体等免疫检查点抑制剂的免疫治疗联合...



张昊文副教授、石小林博士与实验团队合影
文章链接:https://www.pnas.org/doi/10.1073/pnas.2208506119
转载请注明出处。
① 凡本网未注明其他出处的作品,版权均属于激光制造网,未经本网授权不得转载、摘编或利用其它方式使用。获本网授权使用作品的,应在授权范围内使
用,并注明"来源:激光制造网”。违反上述声明者,本网将追究其相关责任。
② 凡本网注明其他来源的作品及图片,均转载自其它媒体,转载目的在于传递更多信息,并不代表本媒赞同其观点和对其真实性负责,版权归原作者所有,如有侵权请联系我们删除。
③ 任何单位或个人认为本网内容可能涉嫌侵犯其合法权益,请及时向本网提出书面权利通知,并提供身份证明、权属证明、具体链接(URL)及详细侵权情况证明。本网在收到上述法律文件后,将会依法尽快移除相关涉嫌侵权的内容。
 相关文章
相关文章 网友点评
网友点评
 热门资讯
热门资讯 精彩导读
精彩导读 关注我们
关注我们