水凝胶具有类似于细胞外基质的理化性质,具备良好力学性能、自愈合能力和响应性,可以用于构建组织再生的微纳米仿生结构,并提供微米尺度的表面形态来调节细胞行为,如细胞粘附、迁移或生存增殖分化因子的释放。因此,水凝胶被广泛应用于组织工程和药物递送等领域。然而,制备高精度的三维(3D)任意生物相容性水凝胶支架仍然是一个挑战。为了适应未来生物医学领域的发展,开发具有精细3D几何结构的新型水凝胶材料势在必行。
近日,中国科学院理化技术研究所仿生智能界面科学中心有机纳米光子学实验室郑美玲研究员团队在ACS Applied Materials & Interfaces上发表了题为“22 nm Resolution Achieved by Femtosecond Laser Two-Photon Polymerization of a Hyaluronic Acid Vinyl Ester Hydrogel” (DOI: 10.1021/acsami.3c04346)的研究成果,提出了一种真3D高精细任意可设计拓扑结构调控单细胞的新策略。
该论文的第一作者为2021级硕士研究生段琦,通讯作者为郑美玲研究员。
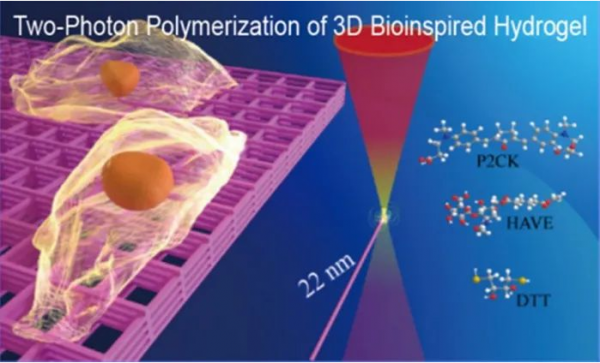
图1 3D水凝胶的制备示意图
作者采用飞秒激光双光子聚合技术,以乙烯基酯透明质酸(HAVE)水凝胶作为单体材料,P2CK作为高效水溶性双光子引发剂,二硫苏糖醇(DTT)作为硫醇-烯点击化学交联剂和PBS缓冲溶液配制了HAVE前驱体,通过配方优化和激光焦点调控在水凝胶结构分辨率上取得了重要突破,最高分辨率达到22 nm,制备了与细胞尺寸相当的水凝胶3D微支架并验证了材料与结构的生物相容性,表明HAVE水凝胶细胞支架可以进一步用于研究细胞迁移和操作等行为。
研究团队首先开展了配方优化实验,通过改变单体和引发剂的质量比及控制硫醇-烯官能团比例筛选出溶解性好、易于加工和聚合性能良好的HAVE前驱体配方。
表1 A-E系列HAVE前驱体配方优化及性能比较

在几十纳米尺度的分辨率中,体素相对于基底的位置是不可忽略的影响因素。为了进一步提高结构分辨率,该团队根据激光焦点体素理论调控焦点与基底相对位置从而获得更高分辨率的线结构。如图2所示,大功率激光焦点光斑明亮,并且体素体积较大,不易得到最佳焦点位置,而小功率激光焦点光斑较弱,体素体积更小,更容易获得最佳焦点位置,基于此方法获得了更高分辨率的线结构。
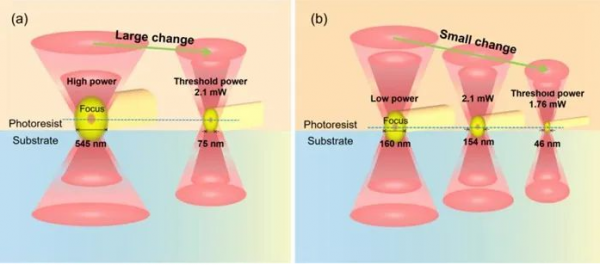
图2 体素形态和相对基底位置对大功率变化(a)和小功率变化(b)聚合线结构分辨率的影响
通过上述配方优化和焦点调控,开展了HAVE前驱体C配方的分辨率研究。当扫描速度为6 μm/s时,线结构的质量得到了显著的提高(图3a),其线结构是完整的、致密的,利用HAVE前驱体C配方实现了22 nm的分辨率(图3c)。
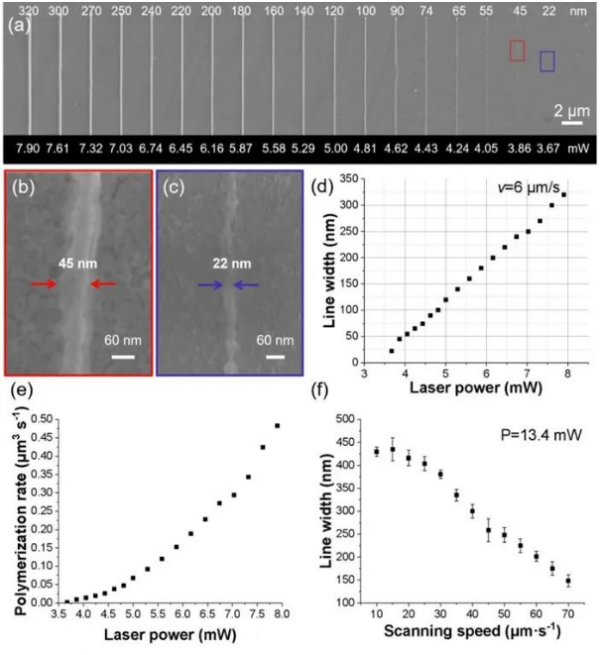
图3 HAVE前驱体C配方双光子聚合性能研究
接着,作者对HAVE前驱体配方进行了3D水凝胶微结构的双光子聚合加工,利用原子力显微镜测量了3D细胞支架的杨氏模量,其平均值94 kPa接近体内组织的力学性能。并对配方中水溶性引发剂P2CK和3D细胞支架进行了生物相容性测试,验证了该材料和结构具有良好的生物相容性。

图4 A和C配方制备的3D细胞支架结构的SEM对比图以及水凝胶支架上共培养L929细胞的共聚焦荧光显微镜图像
综上所述,研究团队全面研究了HAVE水凝胶光刻胶的双光子聚合性能,通过优化光刻胶前驱体的配方和调节焦点位置,获得了22 nm的特征线宽,并验证了材料和3D水凝胶细胞支架的生物相容性。本研究提出的方案有望创建复杂的生物相容性3D水凝胶结构,并探索其在个性化微环境调控、组织工程、生物医学和仿生科学领域的潜在应用。
该工作是研究团队前期一系列仿生水凝胶工作的深入和拓展(Adv. Mater. Technol. 2022, 7, 2200276; ACS Appl. Mater. Interfaces 2021, 13, 27796-27805; ACS Appl. Mater. Interfaces 2019, 11, 1782-1789; ACS Appl. Mater. Interfaces 2017, 9, 42247-42257; Appl. Surf. Sci. 2017, 416, 273-280; J. Mater. Chem. B 2015, 3, 8486-8491; Chem. Soc. Rev. 2015, 44, 5031-5039; J. Mater. Chem. B 2014, 2, 4318-4323)。
相关研究工作得到科技部纳米科技重点专项、国家自然科学面上基金、中国科学院国际伙伴计划等项目的大力支持。相关研究工作得到科技部纳米科技重点专项、国家自然科学基金、北京市自然科学基金和中国科学院国际伙伴计划等项目的资助与大力支持。
转载请注明出处。









 相关文章
相关文章
 热门资讯
热门资讯
 精彩导读
精彩导读
























 关注我们
关注我们




